产品合规
检测/备案/注册
| 为了帮助企业更好地理解进口普通化妆品备案申报要求,上海器审分析了进口普通化妆品备案后检查高频问题,涉及产品安全评估报告、产品执行的标准、产品配方、产品名称命名依据和备案申请表五个方面,现将五部分的内容汇总,帮助企业快速阅读、自查、规避。 |
01
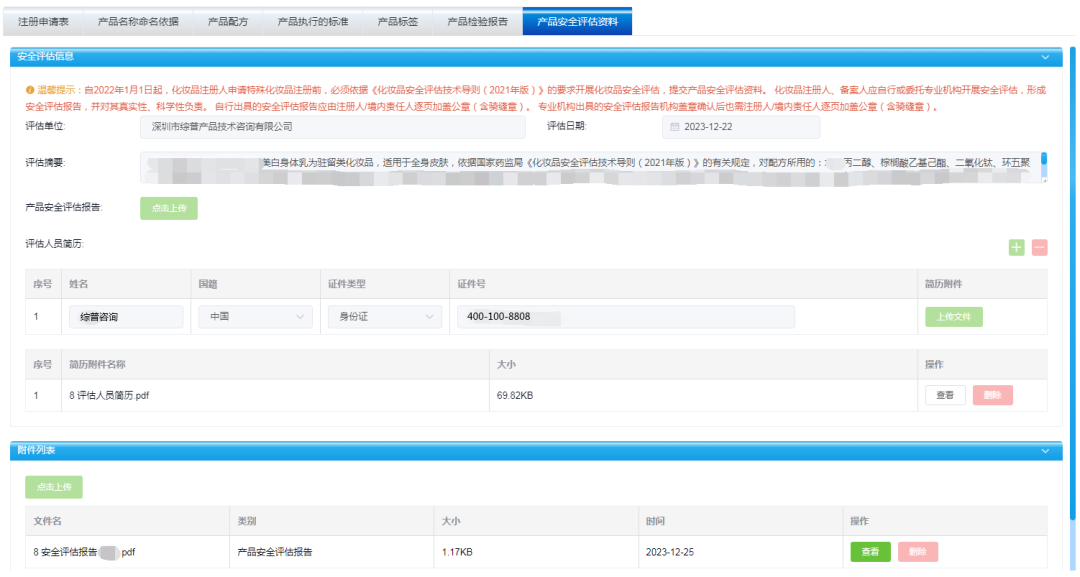
产品安全评估报告
| 1.上传的产品安全评估报告中部分材料未加盖境内责任人公章。 2.产品安全评估资料中未提供安全评估人员简历或安全评估人员简历未包含《化妆品安全评估技术导则》中规定的内容。 《化妆品安全评估技术导则》第2.8条规定:评估人员的简历应附在评估报告之后,简历内容应包括评估人员的教育经历、化妆品相关从业经历、专业培训经历等。 3.未提供符合我国相关国家标准或国际日用香料协会 (IFRA)标准的完整评估资料。 4.未提供《化妆品安全技术规范》中有质量规格要求的原料的质量规格证明或者安全相关信息,如色淀、寡肽-1等。 5.安全评估报告中使用与原料使用目的不一致的安全评估依据。如云母使用目的为填充剂,但使用了着色剂的评估依据。 6.未按照《化妆品安全评估技术导则》要求提供申报产品配方用量下的安全评估信息。 《化妆品安全评估技术导则》规定:9.1 化妆品产品安全评估报告(简化版)可采用的证据。按照以下顺序依次选择至少一种证据进行评估以确定其安全性。 9.1.1 《技术规范》中的限用组分、准用防腐剂、准用防晒剂、准用着色剂和准用染发剂列表中的原料,必须符合其使用要求。 9.1.2 国内外权威机构,如世界卫生组织(WHO)、联合国粮农组织(FAO)、欧盟消费者安全科学委员会(SCCS)、美国化妆品原料评价委员会(CIR)等已公布的安全限量或结论如化妆品安全使用结论、每日允许摄入量、每日耐受剂量、参考剂量、一般认为安全物质(GRAS)等,国际日用香料协会(IFRA)已发布的香料原料标准等,如有限制条件(如刺激性要求等),在符合其限制条件下,结合原料历史使用浓度、产品或原料毒理学测试或人体临床测试结果,可采用其限量或结论;只有系统毒性评估结论的,结合原料历史使用浓度、产品或原料毒理学测试结果或人体临床测试结果,对产品刺激性等局部毒性进行评估后,可采用其限量或结论。 9.1.3 原料在本企业已上市(至少3年)的相同使用方法产品中 的浓度(即:本企业的历史使用浓度)作为评估的证据。使用部位和 使用方法相同产品配方中原料使用浓度原则上应不高于原料在本企业的历史使用浓度,如高于历史使用浓度,应按照本导则进行安全评估证明其安全性;原料历史使用浓度可相互参考,暴露量高和接触时间长的产品,可用于暴露量低和接触时间短的产品评估,但需要从目标人群、使用部位和使用方式等方面充分分析说明其合理性。 使用本企业的历史使用浓度应提供的证明文件包括以下内容: (1)国产特殊产品和进口产品:注册或备案配方(须与申报时提交配方一致),产品注册证书或备案凭证,产品上市证明文件; (2)国产普通 产品:带原料含量或可计算原料含量的生产记录、工艺单、配料单,备案凭证,产品上市证明文件; (3)不良反应监测情况说明; (4)其他证明文件。 9.1.4 以上三种证据类型均不能评估时,化妆品监管部门公布的 原料最高历史使用量可为评估提供参考。需评估产品中原料使用浓度原则上不应高于化妆品监管部门发布的原料最高历史使用量。 9.1.5 对于无法使用上述任一证据类型的原料和/或风险物质,应按照本导则要求的评估程序进行评估证明其安全性。 |
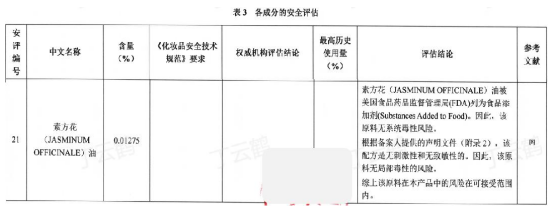
如:产品配方中的21号原料未使用四种证据类型,评估结论中的安全评估内容不完整,无法判断产品安全性
7.涉及产品使用期限延长的,未提交拟变更产品的稳定性研究资料。
《化妆品注册备案资料管理规定》第四十三条第五款规定:涉及产品使用期限延长的,应当提交拟变更产品的稳定性研究资料。
8.产品配方中使用动物脏器组织及血液制品提取物作为原料的,未提供其来源、组成以及制备工艺,以及原料生产国允许使用的相关文件。
《化妆品注册备案资料管理规定》第二十九条第六款规定:产品配方中使用动物脏器组织及血液制品提取物作为原料的,应当提供其来源、组成以及制备工艺,并提供原料生产国允许使用的相关文件。
02
产品执行的标准
产品执行的标准中生产工艺不完整,缺少关键工艺参数或主要步骤,或未包含产品配方中的部分原料。
《化妆品注册备案资料管理规定》第三十条第三款规定:应当简要描述实际生产过程的主要步骤,包括投料、混合、灌装等。应当体现主要生产工艺参数范围,全部原料应当在生产步骤中明确列出,所用原料名称或者序号应当与产品配方中所列原料一致;若同一原料在不同步骤阶段中使用,应当予以区分;若生产过程中需使用但在后续生产步骤中去除的水、挥发性溶剂等助剂,应当予以注明。
2.备案申请表中的生产信息未与产品执行的标准中生产工艺的企业信息保持一致。
《化妆品注册备案资料管理规定》第三十条第三款规定:配方表2个以上原料的预混合、灌装等生产步骤在不同生产企业配合完成的,应当予以注明
3.产品含贴、膜类载体材料,但产品执行的标准感官指标中未描述贴、膜类材料以及浸液的颜色、性状。

4.产品执行的标准项下“感官指标”中“气味”、“性状”、“颜色”填写有误。

《化妆品注册备案资料管理规定》中第三十条第四款规定:应当分别描述产品内容物的颜色、性状、气味等指标。套装产品应当分别说明各部分的感官指标,使用贴、膜类载体材料的产品应当分别描述贴、膜类材料以及浸液的颜色、性状等。
(1)颜色是指产品内容物的客观色泽。同一产品具有可区分的多种颜色,应当逐一描述;难以区分颜色的,可描述产品目视呈现或者使用时的主要色泽,也可描述颜色范围。
(2)性状是指产品内容物的形态。
(3)气味是指产品内容物是否有气味。
5.产品执行的标准中未对防晒剂进行控制。
《化妆品注册和备案检验工作规范》(附1.化妆品注册和备案检验项目要求)规定:非防晒类产品申报配方中使用化学防晒剂的,应当检测所含化学防晒剂。
6.未按照《化妆品注册备案资料管理规定》的要求填报产品执行的标准“微生物和理化指标及质量控制措施”中采用检验方式作为质量控制措施的内容。
《化妆品注册备案资料管理规定》中第三十条第五款规定:采用检验方式作为质量控制措施的,应当注明检验频次,所用方法与《化妆品安全技术规范》所载方法完全一致的,应当填写《化妆品安全技术规范》的检验方法名称;与《化妆品安全技术规范》所载方法不一致的,应当填写检验方法名称,说明该方法是否与《化妆品安全技术规范》所载方法开展过验证,完整的检验方法和方法验证资料留档备查。
7.产品执行的标准中未明确使用期限的标注方式。
《化妆品标签管理办法》中第十四条规定:产品使用期限应当按照下列方式之一在销售包装可视面标注,并以相应的引导语引出:
(一)生产日期和保质期,生产日期应当使用汉字或者阿拉伯数字,以四位数年份、二位数月份和二位数日期的顺序依次进行排列标识;
(二)生产批号和限期使用日期,具有包装盒的产品,在直接接触内容物的包装容器上标注使用期限时,除可以选择上述方式标注外,还可以采用标注生产批号和开封后使用期限的方式。
03
产品配方
1.产品配方项下的“生产商”、“自行填报原料安全信息”未填写。
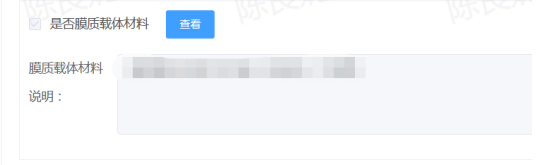
2. 申报产品含膜布,产品配方中未勾选“是否膜质载体材料”,未注明主要载体材料的材质组成,未提供其来源、制备工艺、质量控制指标等资料。
3.产品配方中有原料为色淀形式着色剂,未在着色剂后标注“(色淀)”,且未在配方备注栏中说明所用色淀的种类。
《化妆品注册备案资料管理规定》第二十九条第一款规定:使用着色剂为色淀的,应当在着色剂后标注“(色淀)”,并在配方备注栏中说明所用色淀的种类。
4.产品配方中有原料来源于石油、焦煤油的碳氢化合物(单一组分除外),但未标注相关的化学文摘索引号(CAS号)。
《化妆品注册备案资料管理规定》第二十九条第一款规定:使用来源于石油、煤焦油的碳氢化合物(单一组分除外)的,应当在产品配方表备注栏中标明相关原料的化学文摘索引号(简称 CAS号)。
5.未按照《已使用化妆品原料目录》(2021年版)填报部分原料的标准中文名称和/或INCI名称。
《化妆品注册备案资料管理规定》第二十九条第一款规定:配方成分的原料名称应当使用已使用的化妆品原料目录中载明的标准中文名称、INCI名称或者英文名称。
6.未标注产品配方中部分原料(如直接来源于植物)的具体使用部位。
《已使用化妆品原料目录》(2021年版)规定:本目录中原料名称为“某某植物提取物”形式的,原则上表示该植物全株及其提取物均为已使用原料,使用时应当注明其具体部位。原料名称为“某某植物花/叶/茎提取物”或“某某植物花/叶/藤提取物”形式的,原则上表示该植物的地上部分及其提取物均为已使用原料,使用时应当注明其具体部位。
7.产品配方项下上传的文件未加盖境内责任人公章。
8.配方原料名称相同但分开填报,未在配方表备注栏简要标注分别填报的原因。
《化妆品配方填报技术指导原则》规定:配方原料名称相同但分开填报的,在配方表备注栏简要标注分别填报的原因,如原料具有不同的分子量、不同商品名等。
04
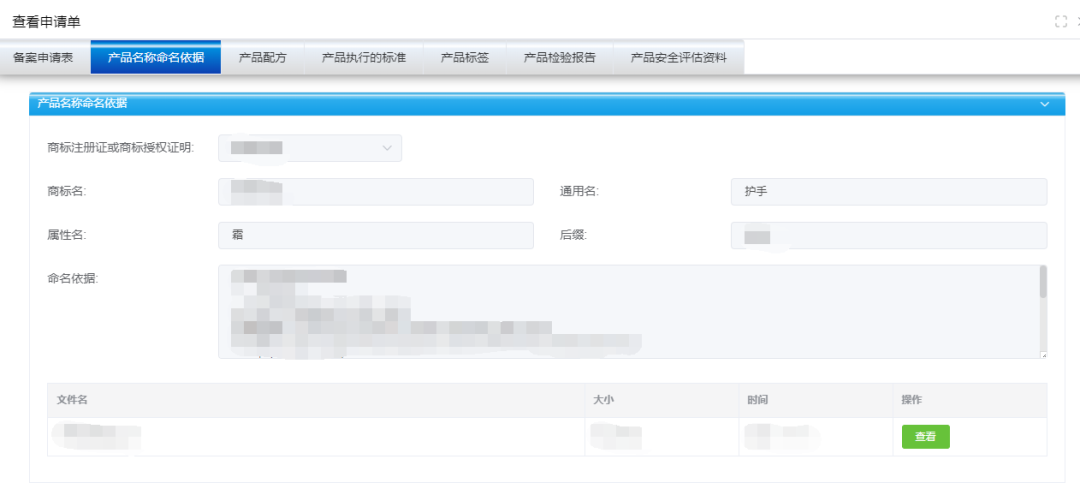
产品名称命名依据
1.备案系统中产品命名依据未完整填写或未完整说明产品名称各部分的具体含义,或未说明中文名称与外文名称的对应关系。
《化妆品注册备案资料管理规定》第二十八条中规定:注册人、备案人应当提交产品名称命名依据,产品名称命名依据中应当指明商标名、通用名、属性名,并分别说明其具体含义。进口产品应当对外文名称和中文名称分别进行说明,并说明中文名称与外文名称的对应关系(专为中国市场设计无外文名称的除外)
2.产品名称命名依据中商标名使用字母、汉语拼音、数字、符号等的,未提供相应的商标注册证或上传的商标注册证文件不清晰或上传的“商标注册证”已过期或商标注册证上的名称与商标名不一致。
《化妆品注册备案资料管理规定》第二十八条中规定:产品中文名称中商标名使用字母、汉语拼音、数字、符号等的,应当提供商标注册证。
3.产品名称中出现了某种原料,但产品配方中并不含该原料。
如:XXX玫瑰护手霜,产品名称含有“玫瑰”,配方不含该原料。
05
备案申请表
1、产品名称与备案申请表分类编码“功效宣称”项所勾选内容不一致,如:产品名称为xx抗皱保湿霜,而功效宣称填报11保湿、09清洁。
2、产品标签标注的使用方法与备案申请表分类编码勾选的“作用部位”、“产品剂型”不一致。如:
(1)备案申请表中作用部位“03躯干部位”与产品标签使用方法中“敷满全身”不一致。
(2)备案申请表中的产品剂型“02 液体”与产品标签中使用方法的“喷洒”不一致。
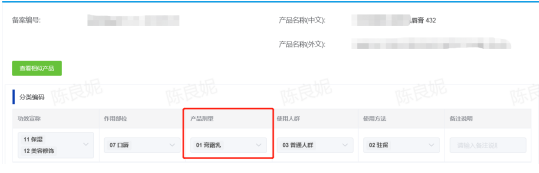
3、备案申请表中的产品剂型与《化妆品分类规则和分类目录》的相应规定不一致。
如:XXX唇膏,以蜡为主要基料,备案申请中分类编码选择“01膏霜乳”与《化妆品分类规则和分类目录》的相应规定不一致。
4、备案申请表项下的产品名称(或备案人、生产企业信息)与产品配方、产品标签、检验报告、安全评估报告等备案资料中填写的相应信息不一致。
5、备案申请表项中“生产信息”栏勾选“境内委托生产”,但未上传委托关系文件。委托关系文件应当至少载明产品名称、委托方、受托生产企业名称、生产地址、本产品接受委托的日期、受托生产企业法人或者法人授权人的签章。
6、未提供由备案人所在国或生产国(地区)政府主管部门或者行业协会等机构出具的已上市销售证明文件,销售证明文件应当至少载明注册人、备案人或者生产企业的名称、产品名称、出具文件的机构名称以及文件出具日期,并由机构签章确认。
7、备案申请表项下上传的部分文件未加盖进口产品的境内责任人公章。
8、申报资料中部分文件为外文,但未提供中文翻译件。