产品合规
检测/备案/注册
研 读 笔 记 — 化 妆 品 原 料 安 全 评 估 程 序 之 危 害 识 别
前 言
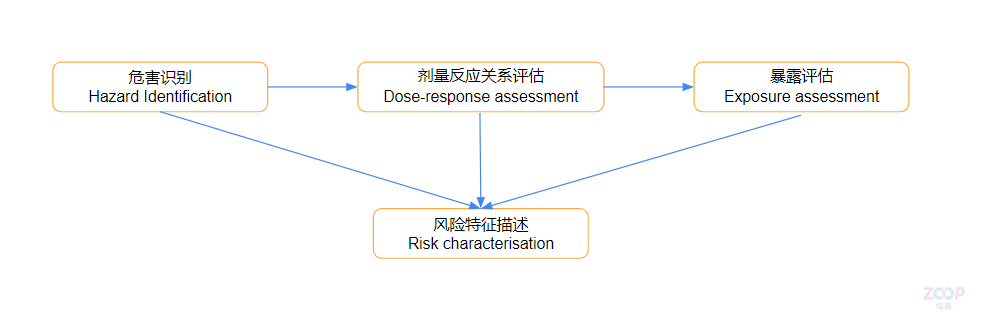
《化妆品安全评估技术导则(2021年版)》明确,化妆品原料和风险物质的风险评估程序分为四个步骤,分别是危害识别、剂量反应关系评估、暴露评估、风险特征描述。
定 义
危害识别(Hazard Identification)是指基于毒理学试验、临床研究、不良反应监测和人群流行病学研究等的结果,从原料和/或风险物质的物理、化学和毒作用特征来确定其是否对人体健康存在潜在危害,原料毒理学数据就是在这个步骤中呈现。
危害识别是定性阶段,目的是鉴定原料的内在毒理学特性(包括物理和化学性质),这些特性与接触无关。
收集到的数据按照证据权重(WOE)的原则,排序如下:
流行病学资料>动物毒理学资料>体外试验资料>构效关系资料
最有说服力的证据当然是来自设计良好的流行病学研究,它能提供人类暴露与毒性之间的确切联系。但是化妆品原料能收集到人体的流行病学数据较少,更多还是来自于毒理试验数据,或者通过构效关系模拟。
毒 理 学 试 验
按照《化妆品安全技术规范》或国际上通用的毒理学试验结果的判定原则对毒性特征进行判定,确定原料和/或风险物质的主要毒性特征及程度。
急性经口试验
定义:一次或在 24h 内多次经口给予实验动物受试物后,动物在短期内出现的健康损害效应。
剂量描述符:LD50 (半数致死量)
试验结果判定:试验结果可作为化妆品原料毒性分级和标签标识以及确定亚慢性毒性试验和其他毒理学试验剂量的依据。
急性经皮试验
定义:经皮一次涂敷受试物后,动物在短期内出现的健康损害效应。
剂量描述符:LD50 (半数致死量)
试验结果判定:急性经皮毒性试验研究和经皮 LD50 的确定提供了受试物经皮染毒的毒性。其结果外推到人类的有效性很有限。急性经皮毒性试验的结果应与经其他途径染毒的急性毒性试验结果相结合进行综合评价。
皮肤刺激性/腐蚀性试验
定义:
皮肤刺激性: 皮肤涂敷受试物后局部产生的可逆性炎性变化。
皮肤腐蚀性: 皮肤涂敷受试物后局部引起的不可逆性组织损伤。
试验目的:急性皮肤刺激性试验观察期限应足以评价该作用的可逆性或不可逆性。
试验结果判定:
化妆品产品的急性皮肤刺激性试验和多次皮肤刺激性试验结果不得有明显的刺激性和腐蚀性,即皮肤刺激强度为轻刺激性及以下(积分均值<2.0)。
急性眼刺激性/腐蚀性
定义:
眼睛刺激性: 眼球表面接触受试物后所产生的可逆性炎性变化。
眼睛腐蚀性:眼球表面接触受试物后引起的不可逆性组织损伤
试验目的:确定和评价化妆品原料及其产品对哺乳动物的眼睛是否有刺激作用或腐蚀作用及其程度,为人类眼和粘膜接触该受试物的潜在危害提供资料。
皮肤致敏性
定义:
皮肤变态反应(过敏性接触性皮炎):是皮肤对一种物质产生的免疫源性皮肤反应。在人类这种反应可能以瘙痒、红斑、丘疹、水疱、融合水疱为特征。动物的反应不同,可能只见到皮肤红斑和水肿。
试验方法:局部封闭涂皮试验,局部封闭涂皮试验。
试验结果判定:按照《化妆品安全技术规范》中变态反应试验皮肤反应积分表进行评分,并按照致敏强度分级表判定致敏强度。
皮肤光毒性- 原料具有紫外吸收特性需要做此项目
定义:光毒性指皮肤一次接触化学物质后,继而暴露于紫外线照射下所引发的一种皮肤毒性反应,或者全身应用化学物质后,暴露于紫外线照射下发生的类似反应。
试验结果判定:单纯涂受试物而未经照射区域未出现皮肤反应,而涂受试物后经照射的区域出现皮肤反应分值之和为 2 或 2 以上的动物数为 1 只或 1 只以上时,判为受试物具有光毒性。
皮肤光变态反应 (IV型过敏反应)-原料具有紫外吸收特性需要做此项目
定义:皮肤接触受试物并经过紫外线照射,通过作用于机体免疫系统,诱导机体产生光致敏状态,经过一定间歇期后,皮肤再次接触同一受试物并在紫外线照射下,引起特定的皮肤反应,其反应形式包括:红斑,水肿等。
试验结果判断:试验结果应能得出受试物的光变态反应能力,必要时给出受试物的光致敏强度。I级致敏度(弱致敏度)没有意义,在实际使用下无致敏危险。
遗传毒性
至少应包括一项基因突变试验和一项染色体畸变试验。如果两组试验中出现任意试验阳性结果,再进行体内试验。而细菌回复突变试验出现阳性结果时,应考虑受试物的纯度,以确定阳性结果是否污染物所致,氨基酸(组氨酸或色氨酸)污染可能导致菌落数的升高而出现假阳性结果。
重复剂量毒性
对试验物种的预期寿命内的特定时间重复每日暴露或接触某种物质而产生的一般性有害毒理学效应(不包括生殖、遗传毒性和致癌效应)。在我国,重复毒性试验主要用于评估化妆品原料的毒性。重复剂量(亚慢性/慢性)毒性检测可根据时间分为28天和90天甚至更长;根据暴露途径,可分为经口、经皮、吸入三种方式。
剂量描述符:
未观察到有害作用的剂量水平 no observed adverse effect level(NOAEL)
观察到有害作用的最低剂量水平 Lowest observed adverse effect level(LOAEL)
亚慢性经口/经皮毒性试验能够提供受试物在经口反复接触时的毒性作用资料。其试验结果可在很有限的程度上外推到人,但它可为确定人群的允许接触水平提供有用的信息。
生殖发育毒性
《化妆品安全技术规范》中有一个致畸试验,是检测妊娠动物接触化妆品原料后引起胎鼠畸形的可能性,即在胚胎发育的器官形成期给妊娠动物染毒,在胎鼠出生前将妊娠动物处死,取出胎鼠检查其骨骼和内脏畸形。周期大约3个月。若致畸试验结果阳性则不再继续进行生殖毒性试验和生殖发育毒性试验。
2023年9月7日发布的《生殖发育毒性试验意见稿》,包括生殖发育毒性试验应包括扩展一代生殖发育毒性试验和两代生殖发育毒性试验方法。
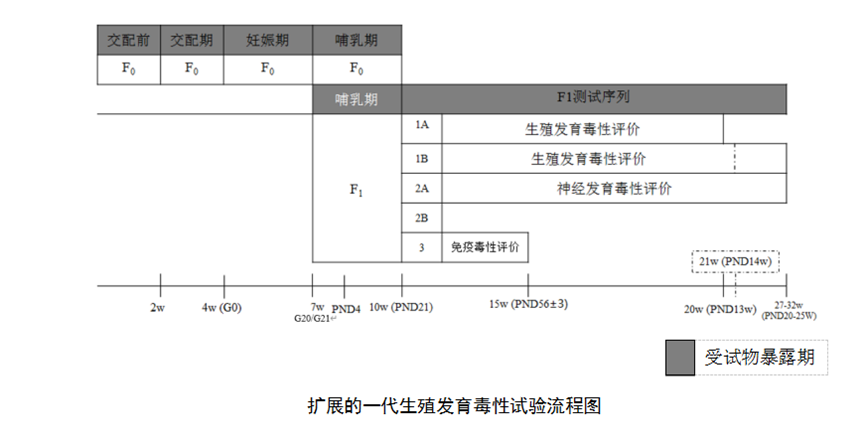
A. 扩展一代生殖发育毒性试验
从F0持续暴露至F1离乳,观察受试物对F0的生育力、生殖系统和F1的生殖(满足触发条件的情况下)和发育影响。
扩展一代生殖发育毒性试验增强了对F1代发育的评价功能。以亚组的形式分别评价F1的生殖和全身毒性,潜在的生殖毒性,潜在的神经发育毒性和潜在的发育免疫毒性。其中对后面三种潜在发育毒性的研究规定了触发条件,仅在满足相关实验终点判定依据(内部触发)或不具有相关毒理资料(外部触发)的情况下方开展进一步的潜在发育毒性研究。
扩展一代生殖发育毒性研究资料可以提供受试物在生殖周期所有阶段重复暴露的影响。尤其是提供了有关生殖系统以及子代最长至PND90的生长发育、存活情况及功能终点的信息。该研究的结果应结合受试物相关资料分析,包括物化特性、TK和毒性效应特征,其它相关信息,如结构类似物毒性资料,该受试物已有的毒理研究资料(例如急性毒性、重复剂量毒性、毒理机制研究以及关于种属特异性的定量及定性体内外代谢特征研究)。
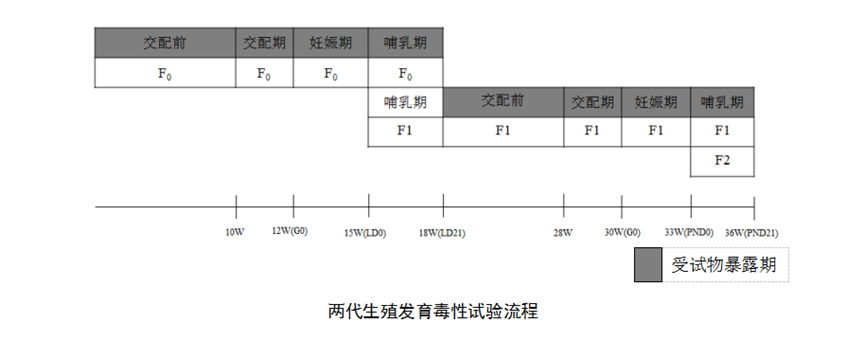
B. 两代生殖发育毒性试验
从F0持续暴露至F2离乳,观察受试物对F0的生育力、生殖系统和F1的生殖和发育影响。
与扩展一代生殖发育毒性试验相比,两代生殖发育毒性周期较长,且缺少对F1免疫系统发育的关注。在开展试验前对受试物资料分析的过程中,若发现有免疫发育毒性提示,建议增加免疫系统(如胸腺、脾脏、骨髓、暴露途径相关淋巴结和远端淋巴结)的组织病理检查。
两代生殖发育毒性研究资料可以提供受试物在生殖周期所有阶段重复暴露的影响。尤其是提供了有关生殖功能及生育力相关参数以及关于后代生长发育和存活情况的信息。该研究的结果应结合亚慢性毒性、产前发育、毒性动力学以及其他现有研究的结果来解释。其结果有助于评估是否有必要将受试物推进到下一个研究节点。同时,该结果在一定程度上外推至人是有效的,可以用于提供NOAEL及人体暴露风险信息。
慢性毒性/致癌性
当某种化学物质经短期筛选试验(如遗传毒性试验)预测具有潜在致癌性,或其化学结构与某种已知致癌剂相近时,需用致癌性试验进一步验证。
毒代动力学
毒代动力学试验需要具体问题具体分析,人体暴露于化妆品主要是通过皮肤。化妆品成分必须穿过皮肤的许多细胞层,才能到达循环(血液和淋巴管)系统,其中决定速率的层是角质层。
对于无透皮吸收的化妆品原料,无需进行毒代动力学研究,但需提供无透皮吸收的客观证明资料;对于透皮吸收且在人体体内有较高暴露的化妆品原料,需进行毒代动力学研究。
注 意 事 项
1. 原料人群流行病学调查、人群监测以及不良反应事件报告等相关资料,应根据所提供的资料判定该原料和/风险物质可能对人体产生的健康危害效应。
2. 在进行危害识别时,还应考虑原料的纯度和稳定性、其可能与产品中其他原料发生的反应以及透皮吸收的能力等,同时还应考虑到原料和生产过程中不可避免带入的风险物质的健康危害效应等。这部分可通过参考原料供应商提供的原料原料质量规格文件,安全性风险物质控制和原料安全风险评估结论等与原料安全相关的信息。
3. 对于复配的原料,应对复配原料本身和/或每种组分的危害效应进行识别。